Por Mtro. Ángel Josabad Alonso Castro
Profesor de la División de Ciencias Naturales y Exactas
Ante esta emergencia internacional que enfrentamos, se requiere la búsqueda de nuevos tratamientos farmacológicos contra el Covid-19 y otras enfermedades emergentes tales como el zika, chikungunya, etc.
EL DESARROLLO DE UN NUEVO FÁRMACO TIENE DOS ETAPAS:
LA ETAPA PRECLÍNICA Y LA ETAPA CLÍNICA.
La investigación preclínica es de suma importancia para evitar tragedias como la ocurrida por el uso de la talidomida en mujeres embarazadas durante principios de la década de los 60. Este fármaco se utilizó para el tratamiento de náuseas en mujeres embarazadas y ocasionó múltiples malformaciones congénitas (Vargesson, 2015).
LOS PROTOCOLOS PRECLÍNICOS DEBEN SER REVISADOS POR UN COMITÉ DE INVESTIGACIÓNEN BIOÉTICA.
Una vez que se cuente con el protocolo aprobado, ya se puede iniciar el desarrollo del proyecto. Nuestro grupo de investigación se centra en realizar pruebas preclínicas con extractos vegetales, compuestos puros obtenidos de plantas medicinales y compuestos obtenidos por síntesis química. Los modelos farmacológicos que evaluamos se centran en el uso de células y de animales de laboratorio. Estos modelos bio-lógicos evalúan aspectos de farmacología y toxicología que pueden ser usados para elaborar estudios clínicos.

El tiempo de desarrollo de la etapa preclínica
puede variar entre 2 a 5 años y requiere una inversión entre 100 y 500 mil dólares.
La etapa clínica comprende cuatro fases.
El tiempo transcurrido entre estas cuatro etapas es entre 8 y 12 años y los costos totales pueden ascender los 1000 millones de dólares.
Por este motivo se proporciona a la compañía farmacéutica una patente de 20 años de duración. En este tiempo, la farmacéutica tiene la exclusividad para vender el medicamento en todo el mundo.
En México, el protocolo para realizar un estudio clínico se somete ante la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS). Para que este protocolo sea aprobado se necesita mostrar evidencia científica de la etapa preclínica, donde los resultados muestren que el nuevo fármaco fue eficaz y seguro en células y en animales de laboratorio.
LA FASE 1
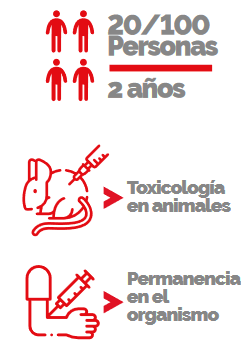
de la etapa clínica consiste en evaluar el fármaco en un grupo pequeño (20-100) de voluntarios sanos.
Su duración es de máximo 2 años. Los resultados obtenidos durante esta etapa permiten evaluar la presencia de efectos adversos del nuevo fármaco en humanos.
Si bien la fase preclínica evalúa la toxicología en animales de laboratorio, no todas las reacciones adversas que pudiera presentar el fármaco serán apreciadas en animales de laboratorio. Esta fase también proporciona información del tiempo que permanecerá el fármaco en el organismo. Los voluntarios saben en todo momento qué tratamiento están consumiendo.

LA FASE 2
tiene por objetivo evaluar la eficacia del nuevo fármaco en pacientes enfermos que no estén recibiendo ningún otro medicamento y que no cuenten con enfermedades hepáticas o renales.
El número de participantes es entre 50 a 500 y su duración es de 2 a 5 años. En esta fase, el paciente desconoce qué tratamiento está recibiendo, sólo los investigadores y el bioestadístico conocen qué tratamiento está consumiendo cada participante.
Los tratamientos comúnmente usados en esta fase son el placebo y el nuevo fármaco. Si el nuevo fármaco muestra una eficacia con respecto al placebo se procede a continuar con el estudio clínico.

EN LA FASE 3
participan de 1000 a 3000 pacientes con la enfermedad de estudio. Su duración es de 3 a 7 años.
En esta fase se compara la eficacia del nuevo fármaco con respecto a un fármaco de referencia. La asignación de los pacientes a cada grupo de estudio se realiza de forma aleatoria.
En esta etapa se prefiere que tanto los pacientes participantes como los investigado-res desconozcan qué tratamiento está recibiendo cada grupo de estudio.
Solamente el bioestadístico sabe qué tratamiento recibe cada grupo experimental. En esta etapa pueden participar pacientes de diferentes países.
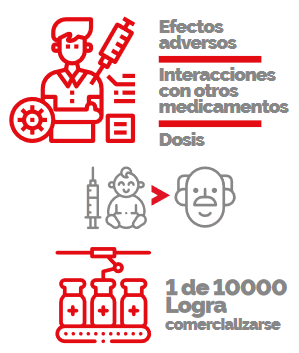
LA FASE 4
corresponde a la vigilancia continua de posibles efectos adversos del nuevo fármaco, así como la evaluación de interacciones con otros medicamentos, o la evaluación de diferentes formas de dosificación.
En esta fase también se pueden incluir a pacientes como ancianos, niños, y otras poblaciones de riesgo.
El proceso de desarrollo de un nuevo fármaco es costoso y complicado. Aproximadamente 1 de cada 10 000 nuevas moléculas que inician con estudios preclínicos conseguirá comercializarse. Además, el 90% de las moléculas que inician con un estudio clínico no lograrán culminar en fase 4 (Issa et al., 2017).
Sin embargo, es necesario invertir en la búsqueda de nuevos tratamientos y realizar estudios preclínicos y clínicos con el fin de obtener nuevas terapias ante enfermedades emergentes, como las que estamos enfrentando.
Bibliografía
ssa NT, Wathieu H, Ojo A, Byers SW, Dakshanamurthy S (2017). Drug metabolism in preclinical drug development: a survey of the discovery process, toxicology, and computational tools. Curr Drug Metab. 18(6), 556-565.
Vargesson N. (2015). Thalidomide-induced teratogenesis: history and mechanisms. Birth defects research. Part C, Embryo today: reviews, 105(2), 140–156.